В мире, по разным данным, от десяти до шестнадцати миллионов человек страдают болезнью Паркинсона, и ВОЗ прогнозирует, что к середине века этот показатель как минимум удвоится. Патология развивается незаметно долгие годы, затем быстро прогрессирует, сокращая продолжительность жизни. Этот недуг неизлечим, поэтому крайне важно диагностировать его как можно раньше.
Нейроны и дофамин
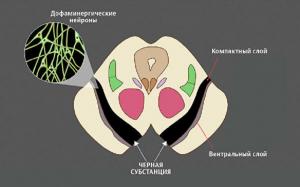
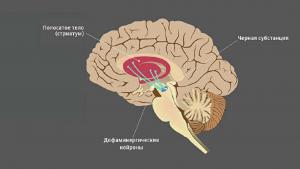
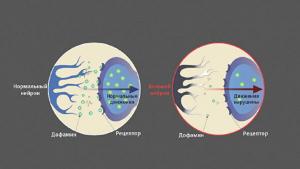
В среднем мозге есть группа нейронов, богатых темным пигментом нейромеланином, — черная субстанция. Их отростки достигают других отделов мозга, в первую очередь стриатума (полосатого тела). Здесь они выделяют дофамин — сигнальную молекулу, регулирующую работу мышц. Если его синтез и обмен в норме, мышцы своевременно сокращаются и расслабляются, нет — их тонус повышен.
Гибель нейронов в черной субстанции ведет к постоянной нехватке дофамина и, как следствие, тяжелому нарушению двигательной функции — болезни Паркинсона. Ее симптомы — проблемы с координацией, скованность движений, замедленность, сутулость, тремор конечностей.
Заболевание быстро прогрессирует, лечению не поддается, заместительная терапия лишь временно улучшает состояние. Человек постепенно превращается в инвалида, его ждет преждевременная смерть. Болезнью Паркинсона страдали многие известные люди — в том числе американский боксер Мухаммед Али, советский актер Михаил Ульянов, папа римский Иоанн Павел II. Недавно об этом диагнозе сообщил британский рок-певец Оззи Осборн.
Сложности ранней диагностики
Некоторые признаки болезни Паркинсона проявляются за несколько лет до явного нарушения движений. Пропадает обоняние, в фазе быстрого сна человек сбрасывает предметы с тумбочки, задевает спящего рядом, может свалиться с верхней полки в поезде. Каждый из этих симптомов характерен для множества патологий, но в совокупности они указывают на скрытое течение болезни Паркинсона (домоторную фазу).
Уточнение диагноза занимает несколько месяцев или даже лет. В спорных случаях прибегают к позитронно-эмиссионной (ПЭТ) или однофотонной эмиссионной компьютерной томографии (ОФЭКТ).
"Вводим в организм радиоизотопные препараты, они включаются в метаболизм нейронов, синтезирующих дофамин. Сканируем мозг и смотрим, как идет синтез. Эти методы позволяют поставить диагноз за несколько лет до двигательных нарушений", — рассказывает профессор, член-корреспондент РАН Сергей Иллариошкин, руководитель отдела исследований мозга Научного центра неврологии.
Правда, сделать ПЭТ и ОФЭКТ удается очень редко: эти процедуры главным образом предназначены для онкологии. Более доступны транскраниальная сонография (УЗИ головного мозга) и МРТ на аппаратах с высокой интенсивностью магнитного поля, тоже фиксирующие признаки деградации черной субстанции. Однако у всей нынешней диагностики болезни Паркинсона общая проблема — она эффективна только в сочетании с клиническими симптомами.
Как любая нейродегенеративная патология, связанная с гибелью определенной группы нейронов, болезнь Паркинсона очень коварна. Все начинается в относительно молодом возрасте и медленно развивается долгие годы, не давая о себе знать. Виной тому — исключительная пластичность мозга. Чтобы компенсировать потерю нервных клеток, оставшиеся работают активнее — больше генерируют дофамина, нейроны-мишени становятся чувствительнее к нему, и только когда все возможности исчерпаны, нервная система выходит из строя с очевидными симптомами.
"Клиника возникает после гибели 50-55% клеток в черной субстанции. Лечить уже поздно. Поэтому и превентивная терапия, такая как антиоксиданты и прочее, неэффективна. Ее надо применять, пока погибло не больше 15-20% нейронов. Но как распознать патологию на этой стадии? Отсюда идея биомаркеров — веществ в организме, указывающих на патогенный процесс или предрасположенность к нему задолго до клинических симптомов", — объясняет профессор.
РНК как биомаркеры
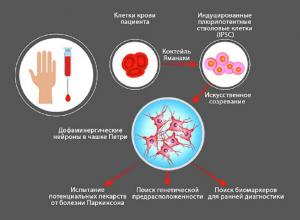
"Одна из серьезных проблем любой нейродегенеративной патологии в том, что для исследования доступна, по сути, только кровь пациентов. Конечно, много работ с мозгом умерших, но искать там маркеры ранней стадии заболевания не очень правильно после многих лет болезни, ее активного лечения, на фоне других частых, характерных для пожилого возраста заболеваний — сердечно-сосудистых, рака", — говорит доктор биологических наук Петр Сломинский, заведующий лабораторией молекулярной генетики наследственных болезней в Институте молекулярной генетики РАН.
Его группа ищет в крови пациентов молекулы — предвестники болезни Паркинсона: микро-РНК, мРНК.
"Гибель нейронов в черной субстанции сопровождают выраженные изменения в экспрессии генов, и мы предполагаем, что то же самое происходит в клетках крови. Гипотеза основана на том, что в лимфоцитах периферической крови экспрессируется ряд генов, связанных с обменом дофамина", — уточняет ученый.
Расчет на то, что гематоэнцефалический барьер — условная граница, запрещающая обмен веществами между мозгом и остальным организмом, — не такой уж непроницаемый и деградация черной субстанции как-то отзовется в периферической крови. Задача — определить группу генов, которые по-разному действуют у больных и здоровых, сравнив их транскриптом — всей совокупностью РНК клеток.
"Для такого исследования особенно подходят образцы крови людей на самой начальной стадии заболевания — до лечения, возможно, влияющего на экспрессию генов. Поэтому пробы берут у пациентов с диагнозом "предполагаемая болезнь Паркинсона" и, через несколько месяцев, — у тех, кому диагноз подтвердили", — продолжает он.
Чтобы создать полноценную панель биомаркеров, нужно много образцов. Идеально было бы наблюдать большую группу людей, регулярно тестировать, выявлять группы риска и потом сравнивать с теми, у кого диагностируют болезнь, а это один процент среди лиц старше 60 лет, независимо от места проживания, этнического происхождения. Поэтому исследование должно быть длительным — необходимо следить за состоянием человека как минимум несколько лет.
Проблема еще и в том, что анализы микро-РНК и мРНК пока неудобны для профилактического скрининга в клинических лабораториях. Требуется ПЦР, а это время, достаточно дорогое оборудование, трудоемкие процедуры. Надежда на то, что когда специфичные для болезни Паркинсона молекулы найдут, появятся и доступные методы их исследования — с учетом того, какой мощный рывок происходит сейчас по экспресс-тестам РНК-содержащих вирусов.
Хор генетических мутаций
В мозге много белка альфа-синуклеина, который участвует в обмене сигналами между нервными клетками, но все его функции не до конца понятны. В здоровых нейронах этот белок, отработав, разрушается, при патологии же накапливается, его длинные нити — фибриллы слипаются в конгломераты (тельца Леви) и становятся токсичными. Мутация в гене альфа-синуклеина приводит к одной из наследственных форм болезни Паркинсона.
Примерно в одном случае из десяти у этой патологии генетические причины. Чаще всего это мутации в генах LRRK2 или PARK8, кодирующих соответственно белки дардарин и паркин. Они вовлечены в многие биохимические процессы в разных типах клеток, но почему-то сбой в них оборачивается образованием телец Леви и гибелью в первую очередь дофаминергических нейронов в черной субстанции.
"Очевидно, белок альфа-синуклеин важен для патологии, но в нем ли первопричина? Есть заболевания, когда он тоже откладывается, например слабоумие с тельцами Леви, — вступает в разговор доктор биологических наук Мария Шадрина, коллега и соавтор Сломинского. — Тут немало параллелей с болезнью Альцгеймера, которая встречается несколько чаще, чем Паркинсона. Там также гибнут нейроны определенного типа, холинергические в гиппокампе, а в мозге накапливается белок бета-амилоид. И эта болезнь скрытно развивается много лет, прежде чем у человека ослабеют память и другие когнитивные функции".
В гипотезах, объясняющих возникновение обеих болезней, недостатка нет. Это и нейровоспаление, запускаемое перенесенной в молодости вирусной инфекцией, и нейротоксины в окружающей среде, например гербициды, и модный сейчас микробиом кишечника, который подозревают в порче альфа-синуклеина.
Проверить все это в эксперименте не так-то просто. Грызуны — излюбленные лабораторные модели биологов — не болеют Паркинсоном.
"Чтобы имитировать болезнь, мыши вводят токсин и уже через шесть часов наблюдают гибель нейронов в черной субстанции, резкое снижение дофамина. У человека эта стадия длится десятки лет. С другой стороны, на грызунах можно промоделировать наследственные формы заболевания, введя в геном мутации", — поясняет Сломинский.
Эксперимент с близнецами
Сейчас ученым представился уникальный шанс — среди пациентов на Дальнем Востоке нашли троих с монозиготными близнецами, не болеющими болезнью Паркинсона.
"Они росли вместе, живут в одном регионе, работа не связана с токсинами. ДНК идентичные, так что если и есть генетическая предрасположенность, то на нее наложились другие факторы", — говорит Мария Шадрина.
Задача — проанализировать транскриптом близнецов, найти гены, которые экспрессируются у них по-разному, установить регулирующие их микро-РНК и связать с болезнью Паркинсона. Однако вопрос о первопричинах патологии остается открытым.
"Одно из объяснений — митохондриальный геном, который передается от матери. У близнецов он разный. Митохондрии размножаются в клетке простым делением и быстро мутируют. Как раз изменение в энергетике клетки, за которую отвечают митохондрии, — один из признаков болезни Паркинсона, — приводит пример Сергей Иллариошкин. Он не исключает и того, что у второго близнеца болезнь проявится позднее. — Мы можем проверить его на ПЭТ, сделать ЭЭГ-видеополисомнографию, чтобы посмотреть реакции в фазе быстрого сна, оценить структуру нигросомы (скопления дофаминовых нейронов) по данным 3-Тесла МРТ в новом режиме. Не исключено, что болезнь уже развивается. Такие примеры есть".
Как растят нейроны
Плюрипотентные стволовые клетки также позволяет исследовать болезнь Паркинсона. Фактически это зародыши, способные превратиться в любой вид зрелых клеток, в том числе нейроны.
Раньше стволовые клетки брали из абортивного материала, плаценты. Теперь, благодаря открытию японского ученого Синьи Яманаки, их можно получить из ткани взрослого человека. Надо немного похимичить в лаборатории, чтобы искусственно состарить, и пожалуйста — зрелые нейроны в чашке Петри. Других вариантов взять их у живого пациента нет.
"Мы создали первую в России коллекцию клеточных линий от пятидесяти пациентов с болезнью Паркинсона. От трех уже есть индуцированные плюрипотентные стволовые клетки. Имеются и трансгенные нейроны, в ДНК которых с помощью системы CRISPR-Cas9 вставили биосенсоры. Они подсвечивают разные процессы на клеточном уровне, например накопление активных форм кислорода", — рассказывает Сергей Медведев из лаборатории эпигенетики развития Института цитологии и генетики СО РАН.
Вместе с коллегами из Новосибирского института органической химии им. Н. Н. Ворожцова и Международного томографического центра СО РАН они на таких искусственных нейронах черной субстанции испытают потенциальные лекарства, замедляющие их гибель, ищут генетические факторы болезни и биомаркеры.
Нагрузочный тест
"Еще ни одного человека не вылечили от болезни Паркинсона. Мы не можем остановить гибель нейронов, потому что не знаем причины. А их может быть огромное количество. Стратегия борьбы направлена на раннюю диагностику и превентивную нейропротекторную терапию, чтобы максимально замедлить процесс. Идеально, если порог гибели нейронов, при котором проявляются клинические симптомы, — это потеря 70-80 процентов дофамина, наступит в возрасте 120-150 лет. Человек будет болеть, но качество жизни останется приемлемым", — рассуждает академик Михаил Угрюмов, заведующий лабораторией нервных и нейроэндокринных регуляций Института биологии развития имени Н. К. Кольцова РАН.
В его лаборатории получают мышей с самой ранней стадией болезни Паркинсона. Затем в их крови ищут совпадения с потенциальными биомаркерами, обнаруженными в крови пациентов с подтвержденным диагнозом.
"Известны десятки биомаркеров и ни одного специфичного, поскольку находим их и при других заболеваниях. В любом случае нужно использовать набор маркеров, но даже по ним диагноз все равно не будет окончательным", — отмечает исследователь.
Он предлагает создать нагрузочный тест для выявления болезни. В психиатрии и неврологии этот подход не используют, а в других областях медицины — вполне. Например, есть тест толерантности к глюкозе при диагностике сахарного диабета.
Ученые уже подобрали вещество, которое блокирует синтез дофамина в мозге и дозу, временно усиливающую симптомы при патологии, без побочных эффектов. Эксперименты на мышах прошли успешно, теперь вместе коллегами из Тайваня исследователи готовят испытания на приматах.
"Есть основания считать, что эта диагностика будет специфична", — подчеркивает академик.
Неудача клеточных технологий
В отличие от клеток кожи или крови, нейроны в головном мозге не возобновляются. Они образуются у эмбриона в возрасте от восьми до 15 недель. По мере старения организма гибнут: в среднем каждые десять лет мозг лишается четырех процентов нервных клеток.
При нейродегенеративном заболевании, по неизвестным пока причинам, скорость гибели нейронов увеличивается в разы. И хотя в гиппокампе и стриатуме есть стволовые клетки-предшественники, доказать, что они замещают погибшие, не удалось.
В начале 1990-х с развитием клеточных технологий возникла идея пересаживать пациентам донорские здоровые нейроны.
"Шведский профессор Андрес Бьорклунд провел эксперименты на мышах, у которых нейротоксинами вызывали болезнь Паркинсона. Однако пересаженные от здорового животного нейроны погибали. Тогда он пересадил больным грызунам нейроны от эмбриона, и у них восстановилось поведение. Это был триумф", — вспоминает Михаил Угрюмов.
На этой волне Бьорклунд запустил в ЕС программу клинических испытаний клеточных технологий для лечения болезни Паркинсона. В ней участвовали шесть стран. Угрюмов руководил научной группой из России. Всего у нас выполнили 13 операций по пересадке нейронов.
"Брали абортивный материал, вырезали ту область мозга, где должны были сформироваться дофаминергические нейроны, делали суспензию и вводили пациенту туда, где был дефицит дофамина. Операция нетравматичная, под местной анестезией. За десять лет во всех европейских странах — участницах консорциума собрали большой материл. Состояние пациентов улучшалось, но через полгода болезнь возвращалась", — говорит ученый.
В США получили те же результаты. Усовершенствование клеточных технологий ситуацию не изменило.
"Везде применяют одну методологию: испытывают терапию на грызунах, потом на людях. Картина общая: стопроцентный успех на животных, никакого стойкого эффекта на людях", — резюмирует академик.
Мозг человека слишком сложно устроен, полагает он. Нейроны нельзя пересадить в черную субстанцию, где для них подходящая окружающая среда, потому что во взрослом мозге они не смогут прорасти в другой отдел. Поэтому их имплантируют сразу туда, где требуется дофамин, — в стриатум.
Мозг мыши залит разными сигнальными веществами, все нейроны работают в этом коктейле. У человека нейроны специализированы, у них свои сигнальные вещества, причем доставка их должна быть направленной.
Нейрон управляется не по всей поверхности, а в точках — синаптических контактах. И каждый связан с десятью-пятнадцатью тысячами других строго определенных нейронов. Все это должна заново сформировать клетка, которую пересадили. В ближайшие лет пятьдесят, по мнению Михаила Угрюмова, эта задача, скорее всего, неразрешима.
Иллюстрации РИА "Новости"
Источник: