S-белок SARS-CoV-2 содержит сайт расщепления, узнаваемый клеточной протеазой фурином. Разрез, вносимый протеазой, необходим для распространения вируса между клетками легких человека. В то же время возбудитель атипичной пневмонии обходится без этого сайта.
Credit:
Markus Hoffmann | Пресс-релиз института
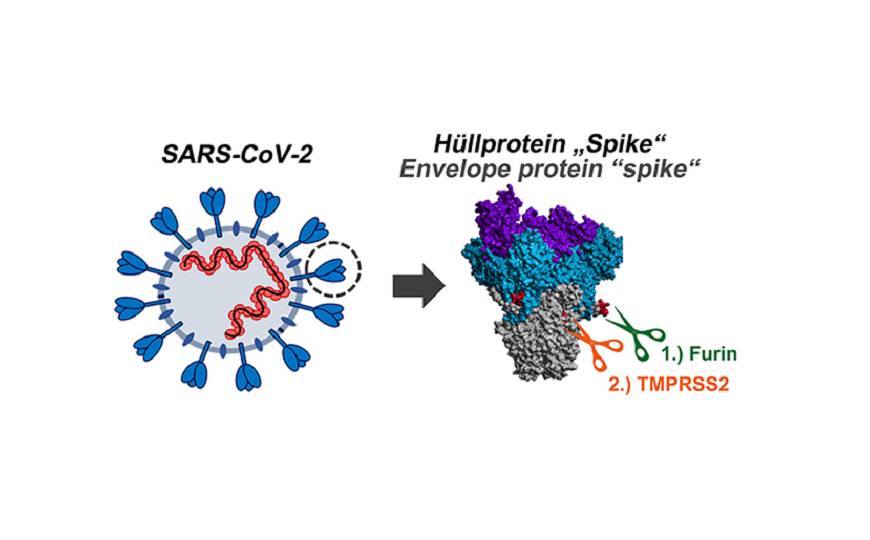
S-белок (spike) коронавирусов входит в состав оболочки и способствует проникновению в клетки. Однако для этого необходимо расщепление S-белка протеазами по двум сайтам — S1/S2 и S2’. Субъединица S1 исходного белка после этого связывается с клеточным рецептором, а трансмембранная субъединица S2 облегчает слияние оболочки вируса с клеточной мембраной. Ученые из Института исследования приматов Лейбница (Геттинген, Германия) решили выяснить, какую роль играет сайт S1/S2 в заражении клеток человека SARS-CoV-2.
Cайт расщепления S1/S2 содержит множественные аргинины; богатая аргининами последовательность совпадает с последовательностью, узнаваемой протеазой фурином. Исследователи решили создать мутантные последовательности с измененным составом. В частности, S-белки с сайтами S1/S2, аналогичными таковым у коронавирусов SARS (атипичной пневмонии) и RaTG13 (коронавирус летучих мышей, сходный с SARS-CoV-2), а также с полным отсутствием остатков аргинина или добавлением одного лишнего вместе с заменой соседнего остатка аланина на лизин. Сайт S1/S2 в S-белке SARS-CoV фурином не узнается, этот белок расщепляют другие протеазы. Нет сайта распознавания фурином и у вируса летучей мыши.
На модели вируса везикулярного стоматита, несущего S-белки, было показано, что замена S1/S2 сайта в оригинальном белке SARS-CoV-2 на мутантные, аналогичные SARS и RaTG13 и с удаленными аргининами, приводит к невозможности его расщепления. Добавление аргинина существенно не повлияло на активацию белка протеазой (однако при этом также была сделана замена соседнего остатка неполярной аминокислоты на остаток положительно заряженной). С другой стороны, вставка в S-белок SARS сайта S1/S2, характерного для SARS-CoV-2, увеличивала расщепляемость белка, тогда как замена на сайт, известный для RaTG13, не приводила к такому эффекту.
Авторы подтвердили, что S-белок SARS-CoV-2 по сайту S1/S2 расщепляет именно фурин: ингибитор фурина расщепление блокировал. Кроме того, с помощью S-белков с измененными сайтами расщепления исследователи установили, что сайт S1/S2 SARS-CoV-2 необходим для индуцированного вирусом слияния зараженных клеток с соседями и образования синцития, причем добавление дополнительного остатка аргинина усиливает слияние. Интересно, что сайт S1/S2, содержащий несколько остатков аргинина, необходим для проникновения SARS-CoV-2 в клетку, хотя вирусу SARS для этого достаточно одного остатка.
Авторы статьи полагают, что ингибиторы протеаз, связанных с активацией S-белка, могут быть использованы для лечения COVID-19. Однако они предупреждают о том, что блокирование действия фурина может вызвать токсические эффекты, так как он необходим для нормального функционирования организма. Поэтому они предлагают обратиться к ингибитору другой протеазы, TMPRSS2, которая распознает сайт S2′ и осуществляет следующий после расщепления фурином шаг активации S-белка (ее роль и способ ингибирования показаны в предыдущей работе этого же коллектива авторов; подробнее на PCR.news).
Исследователи подчеркивают, что следует обратить особое внимание на коронавирусы, имеющие S-белки с высокой тенденцией к расщепляемости: этот признак может быть индикатором возможности переноса вируса к человеку от других животных.
Источник
Hoffmann M., Kleine-Weber H., Pöhlmann S. A Multibasic Cleavage Site in the Spike Protein of SARS-CoV-2 Is Essential for Infection of Human Lung Cells //Molecular Cell, 2020; DOI: 10.1016/j.molcel.2020.04.022